某興趣小組同學為證明NaOH溶液與稀鹽酸發(fā)生了中和反應�,從不同角度設(shè)計了如下實驗方案,并進行實驗�����。
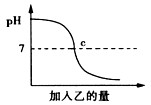
方案一:先用pH試紙測定NaOH溶液的pH�,再滴加鹽酸,并不斷振蕩溶液�����,同時測定混合溶液的pH,如果測得的pH逐漸變小且小于7����,則證明NaOH溶液與稀鹽酸發(fā)生了化學反應。
(1)用pH試紙測定溶液的pH時�����,正確的操作是:__________________________________�����。
(2)簡述強調(diào)“測得的pH小于7”的理由:______________________�����。
方案二:先在NaOH溶液中滴加幾滴酚酞溶液����,溶液顯紅色�,然后再滴加鹽酸,可觀察到紅色逐漸消失��,則證明NaOH溶液與稀鹽酸發(fā)生了化學反應。該組同學在向NaOH溶液中滴加酚酞溶液時����,發(fā)現(xiàn)了一個意外現(xiàn)象:氫氧化鈉溶液中滴入酚酞溶液,溶液變成了紅色�,過了一會兒紅色就消失了。該小組對這種意外現(xiàn)象的原因作了如下猜想:①可能是酚酞溶液與空氣中的氧氣反應����,使紅色消失;②可能是氫氧化鈉溶液與空氣中的二氧化碳反應���,使紅色消失�����。
(3)為驗證猜想①�����,該組同學做了如下實驗:將配制的氫氧化鈉溶液加熱��,并在液面上方滴一些植物油�,然后在冷卻后的溶液中滴入酚酞溶液��。實驗中“加熱”和“滴入植物油”目的是______________。實驗結(jié)果表明酚酞溶液紅色消失與空氣中的氧氣無關(guān)���。
(4)為驗證猜想②���,該組同學做了如下實驗:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液�,發(fā)現(xiàn)溶液也呈現(xiàn)紅色,由此可得出以下兩點結(jié)論:
結(jié)論1:說明Na2CO3溶液呈_______性�����;
結(jié)論2:說明酚酞溶液紅色消失與空氣中的二氧化碳無關(guān)�。
(5)該小組同學通過查閱資料得知:當氫氧化鈉溶液濃度很大時,就會出現(xiàn)上述意外現(xiàn)象�����。請設(shè)計實驗證明該方案中取用的NaOH溶液濃度過大:
①實驗方法_________________________________________________�����,②觀察到的現(xiàn)象_________________________________________________________���。
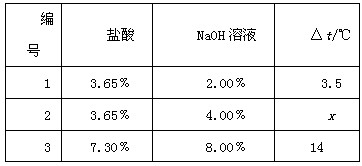
方案三:化學反應中通常伴隨有能量的變化,可借助反應前后的溫度變化來判斷反應的發(fā)生。如果NaOH溶液與稀鹽酸混合前后溫度有變化�����,則證明發(fā)生了化學反應��。該組同學將不同濃度的鹽酸和NaOH溶液各10mL混合�����,用溫度計測定室溫下混合前后溫度的變化��,并記錄了每次混合前后溫度的升高值△t(如下表)���。
(6)表中x=___________�����。
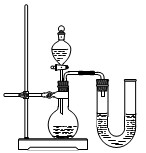
(7)某同學在沒使用溫度計的情況下����,通過下圖所示裝置完成了實驗����。則該同學根據(jù)______________判斷NaOH溶液與稀鹽酸發(fā)生了中和反應��。
(8)關(guān)于實驗中的細節(jié)和意外情況:
①實驗中���,稀鹽酸必須用膠頭滴管逐滴滴加,這樣做的目的是___________________���。
②實驗過程中���,要用玻璃棒不斷攪拌,這樣做的目的是___________________�����。
③在實驗過程中意外發(fā)現(xiàn)有氣泡出現(xiàn)�,你認為原因是_____________________。
④發(fā)現(xiàn)盛放NaOH溶液的試劑瓶瓶口和橡皮塞上出現(xiàn)了白色粉末�����。他們依據(jù)所學的化學知識��,對這種白色粉末的成分作了如下猜想:①可能是NaOH��;你認為:②可能是__________�����;③可能是__________��。