反應(yīng):N2(g)+3H2(g)⇌2NH3(g)△H<0.在等容條件下進(jìn)行.體系中各物質(zhì)濃度隨時(shí)間變化的曲線如圖1所示����,回答問題:
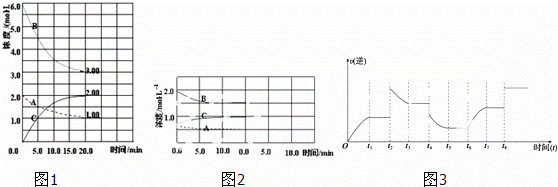
(1)圖1中B為 (填“N2”、“H2”或“NH3”)計(jì)算反應(yīng)從開始→達(dá)平衡時(shí)H2的反應(yīng)速率v(H2)=
(2)圖1是在某溫度下反應(yīng)達(dá)到平衡,將容器的體積擴(kuò)大一倍,假定10min后達(dá)到新的平衡����,請(qǐng)?jiān)趫D2中用曲線表示體系中各物質(zhì)的濃度隨時(shí)間變化的趨勢(shì)(不需計(jì)算新平衡時(shí)的具體濃度,只要新平衡時(shí)濃度處于一個(gè)合理范圍內(nèi)即可.曲線上必須標(biāo)出N2���、H2、NH3).
(3)若該反應(yīng)的逆反應(yīng)速率與時(shí)間的關(guān)系如圖3所示:反應(yīng)在t1����、t3、t5���、t7時(shí)都達(dá)到了平衡���,而t2、t4��、
t6���、t8時(shí)都改變了條件�����,試判斷改變的條件是(填“升溫”�、“降壓”…等);t2時(shí) �;t6時(shí) ;t4時(shí)�����,平衡向 (填“正”或“逆”)反應(yīng)方向移動(dòng).