
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
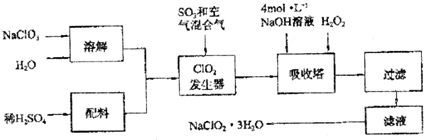
��Ŀ�� ��Դ�� �}�ͣ�����}
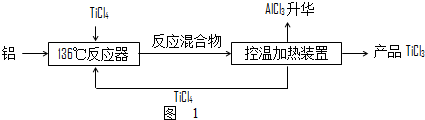
�鿴�𰸺ͽ���>>
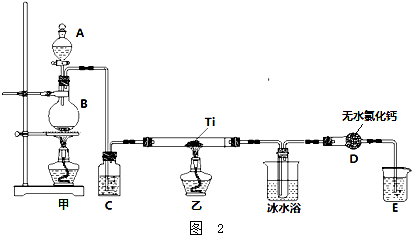
��Ŀ�� ��Դ�� �}�ͣ�����}
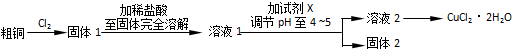
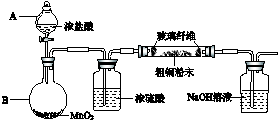
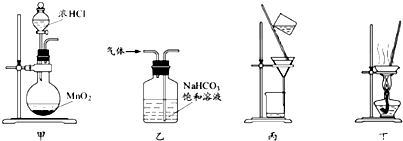
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
 ��
��
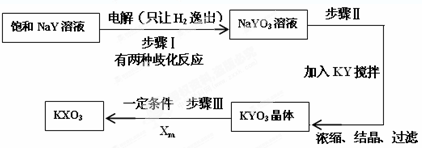
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
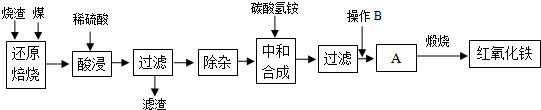
| �������� | Al��OH��3 | Fe��OH��3 | Fe��OH��2 |
| �_ʼ������pH | 3.10 | 2.01 | 7.11 |
| ��ȫ������pH | 4.77 | 3.68 | 9.61 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

| ���|(zh��) | Si | SiCl4 | Cl2 |
| ���c/�� | 2355 | 57.6 | -34.1 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
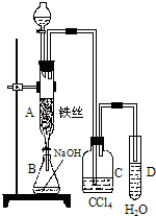
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
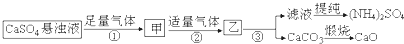
| A�� | ���E�ٺ͢��еĚ��w���ڿ�ѭ�h(hu��n)ʹ�õĚ��w | |
| B�� | ���E���аl(f��)���ķ���(y��ng)�飺Ca2++CO2+2NH3•H2O�TCaCO3��+2NH4++H2O | |
| C�� | ������ͨCO2�����ڣ�NH4��2SO4���� | |
| D�� | �����漰�Ļ��W(xu��)����(y��ng)��������߀ԭ����(y��ng) |
�鿴�𰸺ͽ���>>
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com