
┐Ų─┐Ż║ üĒį┤Ż║ Ņ}ą═Ż║
| ||
| ||
▓ķ┐┤┤░Ė║═ĮŌ╬÷>>
┐Ų─┐Ż║ üĒį┤Ż║ Ņ}ą═Ż║
| ┤▀╗»ä® |
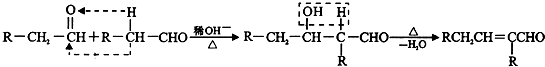

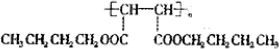
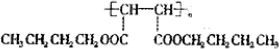
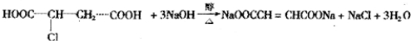
▓ķ┐┤┤░Ė║═ĮŌ╬÷>>
┐Ų─┐Ż║ üĒį┤Ż║ Ņ}ą═Ż║



| ||
| ||
▓ķ┐┤┤░Ė║═ĮŌ╬÷>>
┐Ų─┐Ż║ üĒį┤Ż║ Ņ}ą═Ż║

| ||
| ||
▓ķ┐┤┤░Ė║═ĮŌ╬÷>>
┐Ų─┐Ż║ üĒį┤Ż║ Ņ}ą═Ż║
▓ķ┐┤┤░Ė║═ĮŌ╬÷>>
┐Ų─┐Ż║ üĒį┤Ż║ Ņ}ą═Ż║
▓ķ┐┤┤░Ė║═ĮŌ╬÷>>
░┘Č╚ų┬ą┼ - ŠÜ┴Ģ(x©¬)āį(c©©)┴ą▒Ē - įćŅ}┴ą▒Ē
║■▒▒╩Ī╗ź┬ō(li©ón)ŠW(w©Żng)▀`Ę©║═▓╗┴╝ą┼Žó┼eł¾(b©żo)ŲĮ┼_(t©ói) | ŠW(w©Żng)╔Žėą║”ą┼Žó┼eł¾(b©żo)īŻģ^(q©▒) | ļŖą┼įp“_┼eł¾(b©żo)īŻģ^(q©▒) | ╔µÜv╩Ę╠ō¤oų„┴xėą║”ą┼Žó┼eł¾(b©żo)īŻģ^(q©▒) | ╔µŲ¾ŪųÖÓ(qu©ón)┼eł¾(b©żo)īŻģ^(q©▒)
▀`Ę©║═▓╗┴╝ą┼Žó┼eł¾(b©żo)ļŖįÆŻ║027-86699610 ┼eł¾(b©żo)Ó]ŽõŻ║58377363@163.com