
ΩΤΡΩΘΚ ¹μ(l®Δi)‘¥ΘΚ ν}–ΆΘΚ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ ¹μ(l®Δi)‘¥ΘΚ ν}–ΆΘΚ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ ¹μ(l®Δi)‘¥ΘΚ ν}–ΆΘΚ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ ¹μ(l®Δi)‘¥ΘΚ ν}–ΆΘΚ
 2Θ®t-BuNOΘ©Θ°
2Θ®t-BuNOΘ©Θ°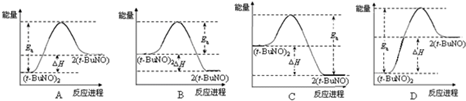
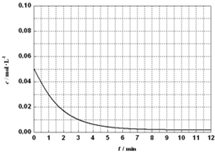
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ ¹μ(l®Δi)‘¥ΘΚ ν}–ΆΘΚ

+ 4 |
+ 4 |
2- 4 |
+ 4 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ ¹μ(l®Δi)‘¥ΘΚ ν}–ΆΘΚιÜΉxάμΫβ
| 0.8m(V2-V1) |
| W |
| 0.8m(V2-V1) |
| W |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ ¹μ(l®Δi)‘¥ΘΚ ν}–ΆΘΚ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΨöΝï(x®Σ)É‘(c®®)Ν–±μ - ‘΅ν}Ν–±μ
Κΰ±± ΓΜΞ¬™(li®Δn)ΨW(w®Θng)Ώ`Ζ®ΚΆ≤ΜΝΦ–≈œΔ≈eàσ(b®Λo)ΤΫ≈_(t®Δi) | ΨW(w®Θng)…œ”–ΚΠ–≈œΔ≈eàσ(b®Λo)¨Θ(zhu®Γn)Ö^(q®±) | κä–≈‘pρ_≈eàσ(b®Λo)¨Θ(zhu®Γn)Ö^(q®±) | …φöv ΖΧ™üo(w®≤)÷ςΝx”–ΚΠ–≈œΔ≈eàσ(b®Λo)¨Θ(zhu®Γn)Ö^(q®±) | …φΤσ«÷ôύ(qu®Δn)≈eàσ(b®Λo)¨Θ(zhu®Γn)Ö^(q®±)
Ώ`Ζ®ΚΆ≤ΜΝΦ–≈œΔ≈eàσ(b®Λo)κä‘£(hu®Λ)ΘΚ027-86699610 ≈eàσ(b®Λo)ύ]œδΘΚ58377363@163.com