
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļ
- 4 |
- 2 |
- 3 |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļ

≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļ

| c2(NH3) |
| c3(H2)c(N2) |
| c2(NH3) |
| c3(H2)c(N2) |
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļťÜ◊xņŪĹ‚
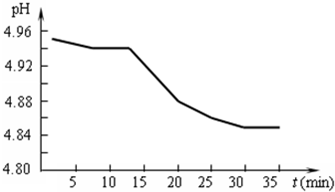 £®1£©SO2ĶńŇŇ∑Ň «‘ž≥…ňŠ”ÍĶń÷ų“™“Úňō£ģń≥ĶōÖ^(q®Ī)ňŠ”ÍpHŽSērťgĶń◊ÉĽĮ»Á”“ąDňý ĺ£ģ’ą”√ĽĮĆW(xu®¶)∑Ĺ≥Ő ĹĪŪ ĺ‘ďĶōÖ^(q®Ī)ňŠ”ÍpHŽSērťg‘Ųľ”∂Ýúp–°Ķń‘≠“Ú
£®1£©SO2ĶńŇŇ∑Ň «‘ž≥…ňŠ”ÍĶń÷ų“™“Úňō£ģń≥ĶōÖ^(q®Ī)ňŠ”ÍpHŽSērťgĶń◊ÉĽĮ»Á”“ąDňý ĺ£ģ’ą”√ĽĮĆW(xu®¶)∑Ĺ≥Ő ĹĪŪ ĺ‘ďĶōÖ^(q®Ī)ňŠ”ÍpHŽSērťg‘Ųľ”∂Ýúp–°Ķń‘≠“Ú| 1 |
| x |
| 1 |
| x |
| 3 |
| x |


≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļ


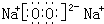
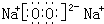
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļ
| ||
| ||
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļťÜ◊xņŪĹ‚
| ||
| ||
| ||
| ||
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļ ĀŪ‘ī£ļ Ó}–Õ£ļ
≤ťŅīīūįłļÕĹ‚őŲ>>
įŔ∂»÷¬–Ň - ĺöŃē(x®™)É‘Ń–ĪŪ - ‘áÓ}Ń–ĪŪ
ļĢĪĪ °Ľ•¬ď(li®Ęn)ĺW(w®£ng)Ŗ`∑®ļÕ≤ĽŃľ–ŇŌĘŇeąů(b®§o)∆ĹŇ_ | ĺW(w®£ng)…Ō”–ļ¶–ŇŌĘŇeąů(b®§o)Ć£Ö^(q®Ī) | Žä–Ň‘pÚ_Ňeąů(b®§o)Ć£Ö^(q®Ī) | …śöv ∑Őďüo÷ųŃx”–ļ¶–ŇŌĘŇeąů(b®§o)Ć£Ö^(q®Ī) | …ś∆ů«÷ôŗ(qu®Ęn)Ňeąů(b®§o)Ć£Ö^(q®Ī)
Ŗ`∑®ļÕ≤ĽŃľ–ŇŌĘŇeąů(b®§o)Žä‘í£ļ027-86699610 Ňeąů(b®§o)ŗ]Ōš£ļ58377363@163.com