
��Ŀ�� ��Դ�� �}�ͣ����x�}
 �±��������|(zh��)������g�ďČ��P(gu��n)ϵ������D��ʾ�P(gu��n)ϵ����
�±��������|(zh��)������g�ďČ��P(gu��n)ϵ������D��ʾ�P(gu��n)ϵ���� | X | Y | Z | |
| A | �⌧(d��o)�w�S | ���������� | ��(f��)�ϲ��� |
| B | ���A | �A | ������ |
| C | 늽��|(zh��) | ������ | ������ |
| D | �ÓQ����(y��ng) | ����߀ԭ����(y��ng) | �şᷴ��(y��ng) |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
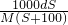 mol/L
mol/L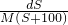 mol/L
mol/L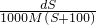 mol/L
mol/L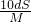 mol/L
mol/L�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
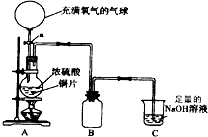 ij�ЌW(xu��)��һ�n���dȤС�M��̽���~������ķ���(y��ng)��r���O(sh��)Ӌ(j��)����D��ʾ�b���M(j��n)�����P(gu��n)��(sh��)�(y��n)��
ij�ЌW(xu��)��һ�n���dȤС�M��̽���~������ķ���(y��ng)��r���O(sh��)Ӌ(j��)����D��ʾ�b���M(j��n)�����P(gu��n)��(sh��)�(y��n)�� ԇ����a��NaOH��Һ��b��Ʒ�t��Һ��c������KMnO4��Һ��d��Ca��OH��2��Һ
ԇ����a��NaOH��Һ��b��Ʒ�t��Һ��c������KMnO4��Һ��d��Ca��OH��2��Һ�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
 �҈D��ij�ЌW(xu��)���W(xu��)��(sh��)�(y��n)�ҏĻ��W(xu��)ԇ���̵��I�ص�HClԇ����(bi��o)���ϵIJ��փ�(n��i)�ݣ�ԇӋ(j��)�㣺
�҈D��ij�ЌW(xu��)���W(xu��)��(sh��)�(y��n)�ҏĻ��W(xu��)ԇ���̵��I�ص�HClԇ����(bi��o)���ϵIJ��փ�(n��i)�ݣ�ԇӋ(j��)�㣺�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| �ض��ܽ���} | 0�� | 10�� | 20�� | 30�� | 40�� | 50�� | 60�� | 100�� |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -�� | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
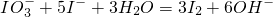
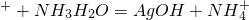
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com