
�}Ŀ�б�(�����𰸺ͽ���)


| m2-m1 |
| 64 |
| m2-m1 |
| 64 |
| ||
| ||
| ||
| ||
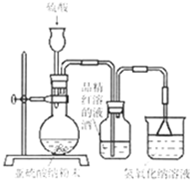 ��2012?����һģ��ij�о��ԌW��С�M���о���������Ư�����Õr���ġ��Ț��Ư�����Ì��H�����Ț��cˮ�������ɵĴ������Ư�����á��õ����l(f��)������̽�������������õõ����Ƕ���������߀�Ƕ��������cˮ���õĮa(ch��n)�ԓС�M�OӋ������Ո�ش����P���}��
��2012?����һģ��ij�о��ԌW��С�M���о���������Ư�����Õr���ġ��Ț��Ư�����Ì��H�����Ț��cˮ�������ɵĴ������Ư�����á��õ����l(f��)������̽�������������õõ����Ƕ���������߀�Ƕ��������cˮ���õĮa(ch��n)�ԓС�M�OӋ������Ո�ش����P���}��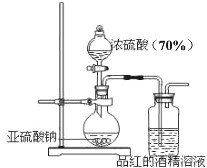 ����̽�����������Ư�����õ����Ƕ���������߀�Ƕ��������cˮ���õĮa(ch��n)�ij�W��С�M�OӋ����D�b�Á��M�Ќ�Ո�ش����P���}��
����̽�����������Ư�����õ����Ƕ���������߀�Ƕ��������cˮ���õĮa(ch��n)�ij�W��С�M�OӋ����D�b�Á��M�Ќ�Ո�ش����P���}��| c��SO32-�� | c��HSO3-�� | c��H2SO3�� | ��ɫ�ٶ� | |
| Na2SO3��Һ | �� | С | С | �� |
| NaHSO3��Һ | �^���� |
�^���� |
�^���� |
�� |
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙��e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com