充滿HCl的燒瓶做完噴泉實驗后得到的稀鹽酸�����,用標(biāo)準(zhǔn)碳酸鈉溶液滴定這種鹽酸測定它的準(zhǔn)確濃度���,請你回答下列問題:
(1)用標(biāo)準(zhǔn)Na2CO3溶液滴定這種鹽酸時����,Na2CO3溶液應(yīng)裝在__________式滴定管中�����,若用甲基橙作指示劑����,達到滴定終點時���,溶液從___________色變?yōu)開_________色��。
(2)現(xiàn)配制三種濃度的標(biāo)準(zhǔn)Na2CO3溶液�,你認(rèn)為最合適的是下列第_______種�。
①2. 500 mol.L-1②0.25 mol. L-1③0. 025 mol.L-1
(3)配制Na2CO3標(biāo)準(zhǔn)溶液的主要操作步驟為:計算→稱量→溶解→___________→洗滌(并將洗滌液移人容量瓶)→_________ →________→將配制好的溶液倒入試劑瓶中,貼上標(biāo)簽���。
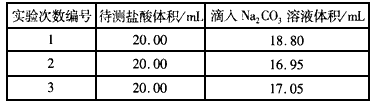
(4)若采用上述合適的標(biāo)準(zhǔn)Na2CO3溶液滴定�����,用c(Na2CO3) 表示�����,滴定時實驗數(shù)據(jù)列表如下:
①求這種待測稀鹽酸的物質(zhì)的量濃度(用數(shù)據(jù)和符號列式即可): c( HCl)=___________
②排去堿式滴定管中氣泡的方法應(yīng)采用如下圖所示操作中的__________�,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。
③在上述實驗中���,下列操作(其他操作正確)會造成測定結(jié) 果偏高的有______��。
A.滴定終點讀數(shù)時俯視讀數(shù)����。
B.酸式滴定管使用前�,水洗后未用待測鹽酸潤洗
C.錐形瓶水洗后未干燥
D.堿式滴定管尖嘴部分有氣泡,滴定后消失