
題目列表(包括答案和解析)
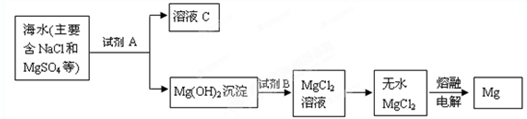

| ||
| ||
下列方程式不正確的是
A.石灰乳中Ca(OH)2的電離:Ca(OH)2(s) Ca2+ + 2OH-
Ca2+ + 2OH-
B.向AgC1懸濁液中滴加Na2S溶液產(chǎn)生黑色沉淀:2AgC1(s) + S2-= Ag2S(s) + 2C1-
C.向NaHCO3溶液中加入過(guò)量的石灰水產(chǎn)生白色沉淀:HCO3- + Ca2+ + OH- = CaCO3↓+ H2O
D.Fe (OH)3膠體的制備:FeCl3 + 3H2O  Fe (OH)3(膠體)+3HCl
Fe (OH)3(膠體)+3HCl
A.澄清石灰水中通少量CO2 Ca(OH)2+CO2====CaCO3↓+H2O
B.石灰乳中加稀鹽酸 OH-+H+====H2O
C.碳酸氫鈉溶液中加稀H2SO4 ![]() +H+====CO2↑+H2O
+H+====CO2↑+H2O
D.鐵加稀鹽酸 2Fe+6H+====2Fe3++3H2↑
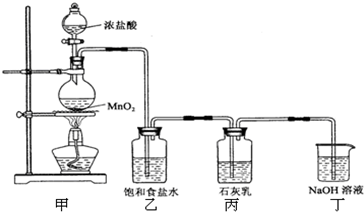
| ||
| ||
| ||
| ||
| ||
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com