
ю}ФПСаБэ(АќРЈД№АИКЭНтЮі)
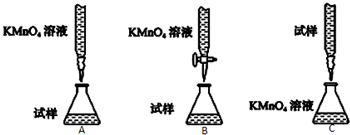
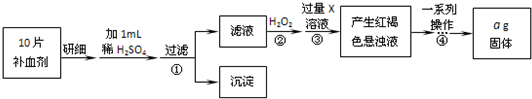
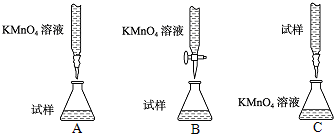
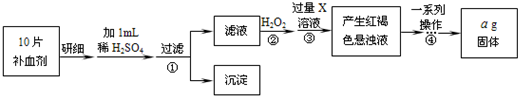
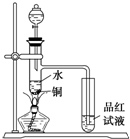 ЯТУцЪЧФГЛЏW(xuЈІ)еnЭтЛюгаЁНMбаОПтH2SO4ЕФбѕЛЏадЕФНY(jiЈІ)еВЂпM(jЈЌn)ааСЫ(shЈЊ)ђ(yЈЄn)ђ(yЈЄn)зCЃК
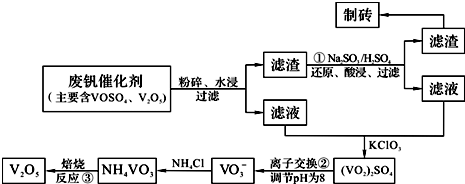
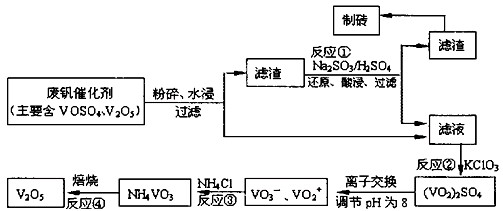
ЯТУцЪЧФГЛЏW(xuЈІ)еnЭтЛюгаЁНMбаОПтH2SO4ЕФбѕЛЏадЕФНY(jiЈІ)еВЂпM(jЈЌn)ааСЫ(shЈЊ)ђ(yЈЄn)ђ(yЈЄn)зCЃК| Юяй|(zhЈЌ) | VOSO4 | V2O5 | NH4VO3 | ЃЈVO2ЃЉ2SO4 |
| ШмНтад | ПЩШм | ыyШм | ыyШм | взШм |
| ||
| ||
| 6 |
| 7 |
| n(SO3) |
| n(SO2) |
| Юяй|(zhЈЌ) | VOSO4 | V2O5 | NH4VO3 | ЃЈVO2ЃЉ2SO4 |
| ШмНтад | ПЩШм | ыyШм | ыyШм | взШм |
АйЖШжТаХ - ОС(xЈЊ)дСаБэ - дю}СаБэ
КўББЪЁЛЅТ(liЈЂn)ОW(wЈЃng)п`ЗЈКЭВЛСМаХЯЂХeѓ(bЈЄo)ЦНХ_ | ОW(wЈЃng)ЩЯгаКІаХЯЂХeѓ(bЈЄo)Ѓ ^(qЈБ) | ыаХдpђ_Хeѓ(bЈЄo)Ѓ ^(qЈБ) | ЩцvЪЗЬoжїСxгаКІаХЯЂХeѓ(bЈЄo)Ѓ ^(qЈБ) | ЩцЦѓЧжр(quЈЂn)Хeѓ(bЈЄo)Ѓ ^(qЈБ)
п`ЗЈКЭВЛСМаХЯЂХeѓ(bЈЄo)ыдЃК027-86699610 Хeѓ(bЈЄo)р]ЯфЃК58377363@163.com