
題目列表(包括答案和解析)
| A.碘化亞鐵溶液中通入少量氯氣:Cl2+2Fe2+=2Fe3++2Cl— |
| B.向1mol/L 0.1L的明礬溶液中加入0.5mol/L 0.2L的Ba(OH)2溶液: 2Al3++3SO42—+ 3Ba2++6OH—=2Al(OH)3↓+3BaSO4↓ |
| C.將蛋殼浸泡到醋酸中:CO32—+2CH3COOH=2CH3COO—+ CO2↑+H2O |
| D.將過氧化鈉與水反應:2O22—+2H2O=O2+4OH— |
取20mL 0.5mol/L的硫酸鈉溶液跟25mL 0.2mol/L的氯化鋇溶液混合,所得溶液中離子濃度由大到小排列正確的是
[ ]
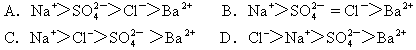
下列離子方程式表達正確的是
| A.碘化亞鐵溶液中通入少量氯氣:Cl2+2Fe2+=2Fe3++2Cl— |
| B.向1mol/L 0.1L的明礬溶液中加入0.5mol/L 0.2L的Ba(OH)2溶液: 2Al3++3SO42—+ 3Ba2++6OH—=2Al(OH)3↓+3BaSO4↓ |
| C.將蛋殼浸泡到醋酸中:CO32—+2CH3COOH=2CH3COO—+ CO2↑+H2O |
| D.將過氧化鈉與水反應:2O22—+2H2O=O2+4OH— |
下列溶液中氯離子濃度最大的是( )
A 400 ml 0.5mol/L BaCl2溶液 B 200 ml 0.5 mol/L MgCl2溶液
C 300 ml 1 mol/L NaCl溶液 D 100ml 0.5 mol/L AlCl3溶液
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com