
題目列表(包括答案和解析)
| 測定時間 | 5:05 | 5:15 | 5:25 | 5:35 | 5:45 |
| PH | 4.95 | 4.94 | 4.86 | 4.84 | 4.84 |
| 測定時間 | 5:05 | 5:15 | 5:25 | 5:35 | 5:45 |
| PH | 4.95 | 4.94 | 4.86 | 4.84 | 4.84 |
| 測定時間 | 5:05 | 5:15 | 5:25 | 5:35 | 5:45 |
| PH | 4.95 | 4.94 | 4.86 | 4.84 | 4.84 |
| 序號 質量 | 實驗1 | 實驗2 | 實驗3 | 實驗4 |
| 鋼樣粉末質量(g) | 2.84 | 4.25 | 6.23 | 7.51 |
| 生成H2的質量(g) | 0.10 | 0.15 | 0.20 | 0.20 |
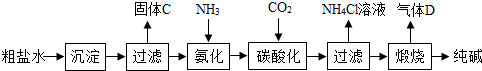
| ||
| ||
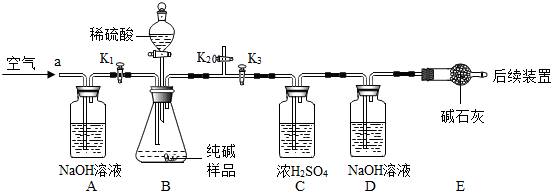
| 106 |
| 10.6g |
| 44 |
| x |
| 106 |
| 10.6g |
| 44 |
| x |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com