
題目列表(包括答案和解析)
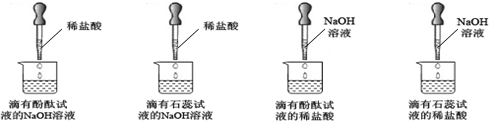
| 紫色石蕊試液 | pH<5.0:紅色 | 5.0<pH<8.0:紫色 | pH>8.0:藍色 |
| 無色酚酞試液 | pH<8.2:無色 | 8.2<pH<10.0:紅色 | pH>10.0:無色 |
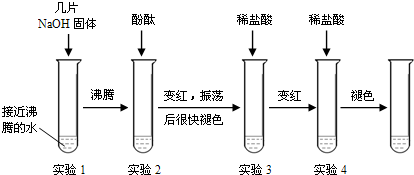
| 溫度/°C | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 64 | 85 | 138 | 203 | 285 | 376 |
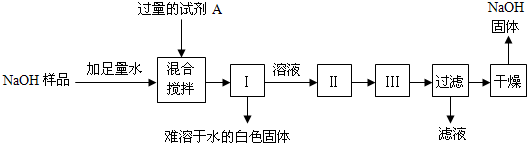
| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
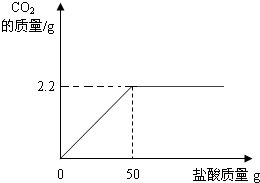
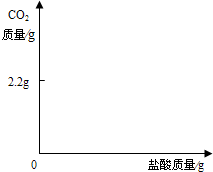
| 2.2g |
| 13.5g-5.3g |
| 13.5g |
| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
| 2.2g |
| 13.5g-5.3g |
| 13.5g |





湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com