
科目: 來源:不詳 題型:實(shí)驗(yàn)題
查看答案和解析>>
科目: 來源:不詳 題型:單選題
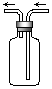
| A.NO | B.N2 | C.CO | D.SO2 |
查看答案和解析>>
科目: 來源:不詳 題型:實(shí)驗(yàn)題
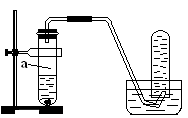
| A.加熱 | B.使用銅粉 | C.稀釋HNO3 | D.改用濃HNO3 |
查看答案和解析>>
科目: 來源:不詳 題型:實(shí)驗(yàn)題
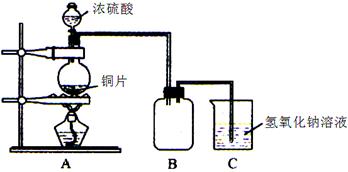
| 方案序號(hào) | 分析 | 誤差(偏低或偏高) | 改變措施 |
| | | | |
| | | | |
| | | | |
| | | | |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.①②④⑤ | B.①②⑤⑦ | C.①②⑤⑥ | D.②⑤⑥⑦ |
查看答案和解析>>
科目: 來源:不詳 題型:實(shí)驗(yàn)題
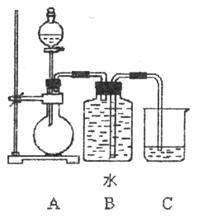
查看答案和解析>>
科目: 來源:不詳 題型:實(shí)驗(yàn)題
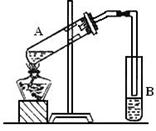
查看答案和解析>>
科目: 來源:不詳 題型:實(shí)驗(yàn)題
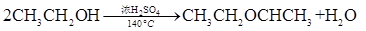
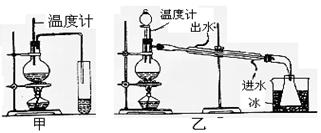
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com