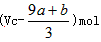���P(gu��n)��(x��)�}
0 14757 14765 14771 14775 14781 14783 14787 14793 14795 14801 14807 14811 14813 14817 14823 14825 14831 14835 14837 14841 14843 14847 14849 14851 14852 14853 14855 14856 14857 14859 14861 14865 14867 14871 14873 14877 14883 14885 14891 14895 14897 14901 14907 14913 14915 14921 14925 14927 14933 14937 14943 14951 203614
��Ŀ��
��Դ��ͬ���}
�}�ͣ�Ӌ(j��)���}
��һ���l��������NO��NH3���l(f��)������(y��ng)����N2��H2O�����F(xi��n)��NO��NH3�Ļ����1mol�������ַ���(y��ng)�����îa(ch��n)�����������(j��ng)߀ԭ�õ���N2�Ƚ�(j��ng)�����õ���N2��1.4g�����
��1����������(y��ng)�Ļ��W(xu��)����ʽ�����p�����(bi��o)������D(zhu��n)�Ʒ���͔�(sh��)Ŀ����
��2�������Ϸ���(y��ng)�M(j��n)����ȫ�����ԇӋ(j��)��ԭ����(y��ng)�������NO�cNH3�����|(zh��)�������Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��ͬ���}
�}�ͣ����x�}
����ͬ�|(zh��)�����~�քe���^��������������ϡ���ᷴ��(y��ng)�����Д������_����
A������(y��ng)���ʣ�������ͬ
B��������������|(zh��)������ǰ�߶����������
C������(y��ng)���ɚ��w���ɫ��ǰ�ߜ\����������
D������(y��ng)���D(zhu��n)�Ƶ���ӿ���(sh��)��ǰ�߶�����������
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ�����(xi��ng)�}
�}�ͣ�����}
����߀ԭ����(y��ng)�Ќ�(sh��)�H�ϰ���������߀ԭ�ɂ�(g��)�^�̡�������һ��(g��)߀ԭ�^�̵ķ���(y��ng)ʽ��NO3-+4H++3e-��NO+2H2O������KMnO4��Na2CO3�������Cu2O���Fe2(SO4)3�ķN���|(zh��)�е�һ�N���|(zh��)���ף���ʹ����߀ԭ�^�̰l(f��)����
��1����������ƽԓ����߀ԭ����(y��ng)�ķ���ʽ��______________________________________�����
��2������(y��ng)�������w�F(xi��n)��___________�������___________���|(zh��)�������
��3������(y��ng)�����a(ch��n)��0.2mol���w�������t�D(zhu��n)����ӵ����|(zh��)������ ____________mol��
��4����1mol���cij������ᷴ��(y��ng)�r(sh��)�����߀ԭ��������|(zh��)�������ӣ�ԭ����___________________����
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0103 ��ĩ�}
�}�ͣ����x�}
�ڷ���(y��ng)�����г����������V1������V2������(bi��o)��(zh��n)��B(t��i)�£������������ú�y�������a(ch��n)���߀ԭ�a(ch��n)���1.6��������������Д��e(cu��)�`���ǣ�
A����V1>11.2,V2>11.2
B����V1+V2��3.36
C���V1=11.2,�tV2��2.24
D�����V2=2.24���tV1��1.12
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ�����(xi��ng)�}
�}�ͣ����x�}
�ڝ��}����H3AsO3�cSnCl2����(y��ng)���x�ӷ���ʽ��3SnCl2+12Cl-+2H3AsO3+6H+==2As+3SNCl62- + 6M������P(gu��n)��ԓ����(y��ng)���f�������_�ĽM����
����������H3AsO3 ��߀ԭ�ԣ�Cl->As ��ÿ����1 mol As����������(y��ng)���D(zhu��n)����ӵ����|(zh��)������3 mol ��M��OH-
A���٢�
B���٢ڢ�
C���ڢۢ�
D��ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0111 �����}
�}�ͣ����x�}
��K2Cr2O7+14HCl(��)=2KCl+2CrCl3+3Cl2��+7H2O��������(d��ng)0.1molK2Cr2O7����(y��ng)�r(sh��)����֪
A��1.4mol HCl������
B���D(zhu��n)����Ӕ�(sh��)1.806��1023
C�������a(ch��n)���0.3mol
D��߀ԭ�a(ch��n)���KCl
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ�����(xi��ng)�}
�}�ͣ����x�}
a mol FeS�cb mol FeOͶ�뵽VL c mol��L-1��������Һ�г�ַ���(y��ng)�����a(ch��n)��NO���w�������ó�����Һ�ijɷֿɿ�����Fe(NO3)3����H2SO4�Ļ��Һ��������t����(y��ng)��δ��߀ԭ��������ܞ�
��(a+b)��63 g ��(a+b)��189 g ��(a+b)mol ��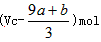
A���٢�
B���ڢ�
C���٢�
D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��ͬ���}
�}�ͣ�Ӌ(j��)���}
�S����C����������Ѫ������������ʽ��C6H8O6�������^��(qi��ng)��߀ԭ�ԣ������ڿ՚����ױ�����������京����ͨ�^����������Һ������֪��Һ��I2��Һ�M(j��n)�еζ�������ԓ����(y��ng)�Ļ��W(xu��)����ʽ���£�C6H8O6+I2==C6H6O6+2HI �F(xi��n)���y��ij��Ʒ�оS����C�ĺ�����������w�IJ��E���y�õĔ�(sh��)��(j��)���������ȡ10mL 6mol��L-1CH3COOH�����������100mL���sˮ��������Һ�ӟ���к������s���������_�Qȡ0.2000g��Ʒ����ܽ���������s����Һ�У�����1mL����ָʾ����������Ý�Ȟ�0.05000mol��L-1��I2��Һ�M(j��n)�еζ���ֱ����Һ�е��{(l��n)ɫ���m(x��)���ʞ�ֹ�������������
21.00mLI2��Һ�������
��1����μ����CH3COOHϡ��ҺҪ�Ƚ�(j��ng)����������s�����ʹ�����___________________
��2��Ӌ(j��)���Ʒ�оS����C���|(zh��)����?j��n)?sh��)��
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��ͬ���}
�}�ͣ�Ӌ(j��)���}
�Ȼ����~(CuCl)����Ҫ�Ļ���ԭ������������Ҙ�(bi��o)��(zh��n)Ҏ(gu��)���ϸ�CuCl�a(ch��n)Ʒ����Ҫ�|(zh��)��ָ��(bi��o)��CuCl���|(zh��)����?j��n)?sh��)����
96.50%�������I(y��)�ϳ�ͨ�^���з���(y��ng)�Ƃ��CuCl
2CuSO4+Na2SO2+2NaCl+Na2CO3==2CuCl��+3Na2SO4+CO2��
(1)CuCl�Ƃ��^������Ҫ�����|(zh��)����?j��n)?sh��)��20.0%��CuSO4��Һ������ԇӋ(j��)������ԓ��Һ�����CuSO4��5H2O�c
H2O���|(zh��)��֮�����
(2)��(zh��n)�_�Qȡ���Ƃ��0.2500gCuCl��Ʒ����һ������0.5mol��L-1FeCl3��Һ�У�����Ʒ��ȫ�ܽ���������ˮ
20mL�������0.1000mol��L-1��Ce(SO4)2��Һ�ζ����K�c(di��n)������24.60mL Ce(SO4)2��Һ����������P(gu��n)���W(xu��)����(y��ng)��
Fe3++CuCl==Fe2++Cu2++Cl- Ce4++Fe2+==Fe3++Ce3+
ͨ�^Ӌ(j��)���f��������Ʒ��CuCl���|(zh��)����?j��n)?sh��)�Ƿ���Ϙ�(bi��o)��(zh��n)�������
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ�����(xi��ng)�}
�}�ͣ������(xi��ng)�x���}
ij�ض��£���Cl2ͨ��KOH��Һ�е�KCl���KClO3�� KClO�Ļ����Һ����(j��ng)�y��ClO3-��ClO-���|(zh��)����֮�Ȟ�2��1����t����(y��ng)�б�߀ԭ��Cl2�c������Cl2�����|(zh��)����֮�Ȟ�
A.2:3
B.3:4
C.11:3
D.10:3
�鿴�𰸺ͽ���>>