
科目: 來源: 題型:
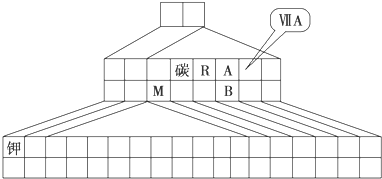
2- 8 |
查看答案和解析>>
科目: 來源: 題型:
| 元素 性質(zhì) |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半徑 (10-10m) |
1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高價(jià)態(tài) | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低價(jià)態(tài) | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:

| 元 素 | D | E | |
| 電離能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目: 來源: 題型:
| a | |||||||
| b | c | d | e | f | |||
| g | h | i | |||||

查看答案和解析>>
科目: 來源: 題型:
| 族周 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA |
| 一 | |||||||
| 二 | a | b | d | e | |||
| 三 | f | g | h | j | |||
查看答案和解析>>
科目: 來源: 題型:
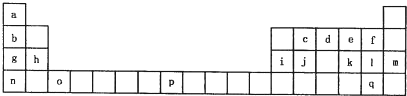
查看答案和解析>>
科目: 來源: 題型:
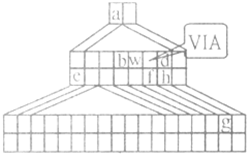 如圖是由Emil Zmaczynski設(shè)計(jì)的金字塔式元素周期表的一部分,圖上標(biāo)有ⅥA族和幾種元素的位置.請回答下列問題:
如圖是由Emil Zmaczynski設(shè)計(jì)的金字塔式元素周期表的一部分,圖上標(biāo)有ⅥA族和幾種元素的位置.請回答下列問題:查看答案和解析>>
科目: 來源: 題型:
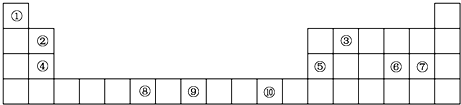
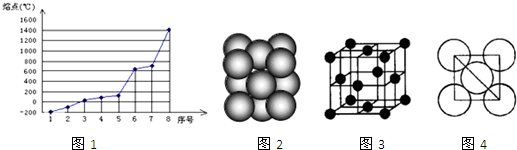
查看答案和解析>>
科目: 來源: 題型:
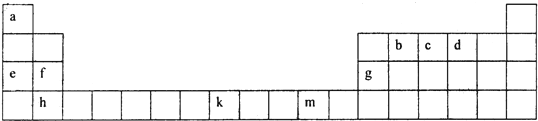

3- 4 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺 | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com