
科目: 來源:不詳 題型:單選題
A.用Pt電極電解少量的CuCl2溶液:2H2O+Cu2++2Cl- H2↑+Cl2↑+Cu(OH)2↓ H2↑+Cl2↑+Cu(OH)2↓ |
| B.0.01 mol/L NH4Al(SO4)2溶液與0.02 mol/L Ba(OH)2溶液等體積混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| C.酸性高錳酸鉀溶液中滴加H2O2溶液4H2O2+ 4MnO4-+ 12H+ =" 4" Mn2+ + 10 H2O + 7O2↑ |
| D.向磁性氧化鐵中加入氫碘酸:Fe3O4 +8H+=Fe2+ +2 Fe3+ +4H2O |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
 Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN- Fe(SCN)2+ K2
Fe(SCN)2+ K2查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.純堿顯堿性的原因:CO32-+ 2 H2O = H2CO3 + 2 OH- |
B.稀鹽酸和稀氫氧化鈉溶液反應(yīng)的中和熱△H=-57.3 kJ/mol,則稀硫酸與稀氫氧化鉀溶液發(fā)生反應(yīng)的熱化學(xué)方程式表示為: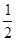 H2SO4(l)+ KOH(l) = H2SO4(l)+ KOH(l) = 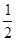 K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol |
| C.明礬溶液中滴加氫氧化鋇溶液至沉淀的物質(zhì)的量最大: 2 Al3+ +3 SO42-+3 Ba2+ +6 OH- =" 2" Al(OH)3 ↓+ 3 BaSO4 ↓ |
D.銅和濃硫酸混合加熱:2H2SO4(濃)+Cu SO2↑+Cu2+ +SO42-+2 H2O SO2↑+Cu2+ +SO42-+2 H2O |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
A.氯氣溶于水:Cl2+H2O H++Cl-+HClO H++Cl-+HClO |
| B.鋁溶于氫氧化鈉溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
| C.少量的CO2 通入氨水中:CO2+NH3?H2O=NH4++HCO3- |
| D.用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
A.HCO3-水解的離子方程式:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| B.漂白粉溶液在空氣中失效:ClO-+CO2+H2O=HClO+HCO3- |
| C.過量的SO2通入NaOH溶液中:SO2—+2OH—=SO32—+H2O |
D.新制氫氧化銅和乙醛反應(yīng):CH3CHO+2Cu(OH)2+OH- CH3COO-+Cu2O↓+3H2O CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.用Fe除去FeCl2溶液中的少量的FeCl3雜質(zhì):Fe+Fe3+=2Fe2+ |
B.實驗室制取NO2:Cu+4H++2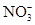 =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
C.硫酸溶液與氫氧化鋇溶液混合:H++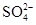 +Ba2++OH-=BaSO4↓+H2O +Ba2++OH-=BaSO4↓+H2O |
D.向氯化鋁溶液通足量氨氣:Al3++4NH3+4H2O=4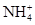 +[Al(OH)4]- +[Al(OH)4]- |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.用FeCl3溶液腐蝕印刷電路板:Fe3++Cu=Fe2++Cu2+ |
| B.醋酸溶液和大理石反應(yīng):CaCO3+2H+=Ca2++H2O+CO2↑ |
| C.NH4Al(SO4)2溶液中滴加少量的NaOH:NH4++OH-=NH3·H2O |
| D.向Na2S2O3溶液中加入稀硫酸:S2O32-+2H+= SO2↑+S↓+ H2O |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
| A.氯化鋁溶液中加入過量氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O |
| B.氧化亞鐵溶于稀鹽酸: FeO + 2H+= Fe2+ + H2O |
| C.二氧化硅與燒堿溶液反應(yīng):SiO2 +2OH-= SiO32- + H2O |
| D.除去氧化膜的鋁片插入硝酸汞溶液中:2Al +3Hg2+= 2Al3+ + 3Hg |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
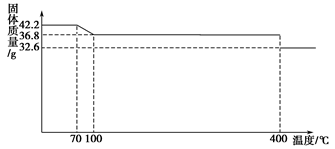
查看答案和解析>>
科目: 來源:不詳 題型:單選題
A.實驗室用氯化鐵溶液制取氫氧化鐵膠體:Fe3++3H2O Fe(OH)3(膠體)+3H+ Fe(OH)3(膠體)+3H+ |
| B.碳酸鈣溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C.鋁和燒堿溶液:2Al+2OH-+2H2O=2Al3++3H2↑ |
| D.AlCl3溶液中加入過量氨水:Al3++4OH- =AlO2-+2H2O |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com