
題目列表(包括答案和解析)
| 元素 | 部分結(jié)構(gòu)知識(shí) | 部分性質(zhì) |
| X | X原子核外電子占有9個(gè)原子軌道 | X的一種氧化物是形成酸雨的主要物質(zhì) |
| Y | Y原子的次外層電子數(shù)等于最外層電子數(shù)的一半 | Y能形成多種氣態(tài)氫化物 |
| Z | Z原子的最外層電子數(shù)多于4 | Z元素的最高正化合價(jià)與最低負(fù)化合價(jià)代數(shù)和等于6 |
| W | W原子的最外層電子數(shù)等于2n-3(n為原子核外電子層數(shù)) | 化學(xué)反應(yīng)中W原子易失去最外層電子形成Wn+ |


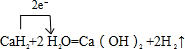
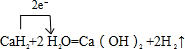
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
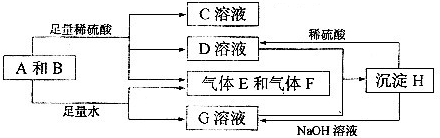
Al(OH)3+3H+| 族 |
I A | II A | III A | IV A | V A | VI A | VII A |
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |  |
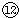 |
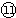 的氫化物的還原性
的氫化物的還原性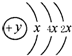 ,在周期表位于
,在周期表位于 與⑧形成化合物形成過程:
與⑧形成化合物形成過程: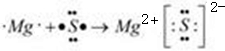
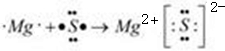
 的最高價(jià)氧化物對(duì)應(yīng)水化物反應(yīng)的離子方程式:⑦與⑨:
的最高價(jià)氧化物對(duì)應(yīng)水化物反應(yīng)的離子方程式:⑦與⑨: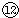
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com