
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | 0.5molCO+2.0molH2O��g��+1.0molCO2+1.0mol H2 | |
| B�� | 1.0molCO+2.0molH2O��g��+0.5molHe | |
| C�� | 1.0molCO+1.0molH2O��g��+1.0molCO2+1.0mol H2 | |
| D�� | 0.5molCO+1.5molH2O��g��+0.4molCO2+0.4mol H2 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| �x�(xi��ng) | A | B | C | D |
| ��һ�μ��� | Al | Na | Zn | Mg |
| �ڶ��μ��� | K | Mg | Al | Cu |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
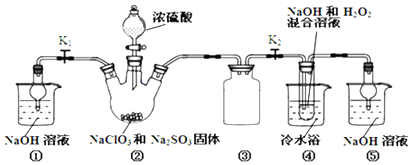
��Ŀ�� ��Դ�� �}�ͣ���(sh��)�(y��n)�}
| ��(sh��)�(y��n)��̖ | �ζ�ǰ�x��(sh��)/mL | �ζ����x��(sh��)/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| �x�(xi��ng) | Ŀ �� | ���x���� | ԭ �� |
| A | ���x����ˮ�еĵ� | �Ҵ���ȡ | �����Ҵ��е��ܽ���^�� |
| B | ���x�����������Ҵ� | ��Һ | �����������Ҵ����ܶȲ�ͬ |
| C | ��ȥ�����л��е���ϩ | ���Ը��i�����Һϴ�� | ��ϩ�c���Ը��i�����Һ����(y��ng)�����鲻�� |
| D | ��ȥ���������л��е����� | ���̼���c��Һϴ����Һ | �������c̼���c����(y��ng)��������ˮ���} |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | 4�(xi��ng) | B�� | 3�(xi��ng) | C�� | 2�(xi��ng) | D�� | 1�(xi��ng) |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com