
科目: 來源: 題型:解答題
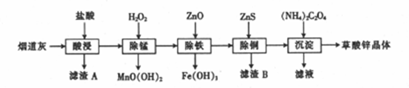
| 氫氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 開始沉淀時的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀時的pH | 3.3 | 9.7 | 6.7 | 8.2 |
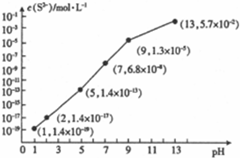
查看答案和解析>>
科目: 來源: 題型:解答題
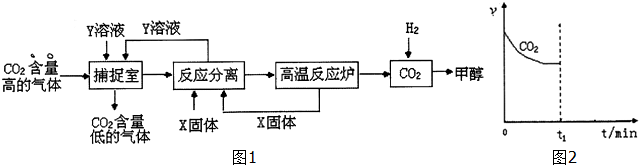
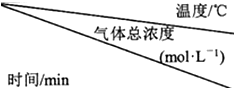 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目: 來源: 題型:解答題
 H2PO4-+H+.
H2PO4-+H+.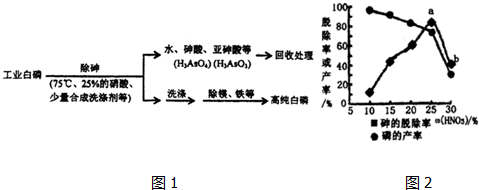
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
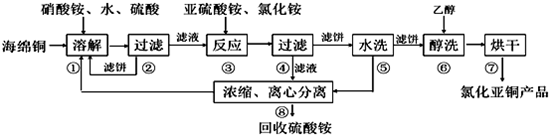
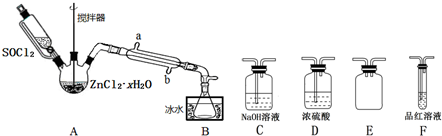
查看答案和解析>>
科目: 來源: 題型:實驗題
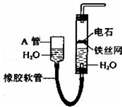 如圖所示實驗裝置可用于制取乙炔.
如圖所示實驗裝置可用于制取乙炔.查看答案和解析>>
科目: 來源: 題型:解答題
| 滴定次數(shù) | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(shù)(mL) | 滴定后讀數(shù)(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 來源: 題型:選擇題
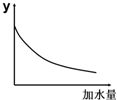
| A. | 溶液的pH | B. | 溶液的導電能力 | ||
| C. | 醋酸的電離平衡常數(shù) | D. | 醋酸的c (OH-) |
查看答案和解析>>
科目: 來源: 題型:解答題
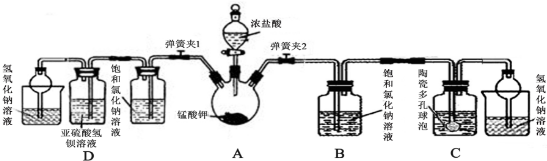
查看答案和解析>>
科目: 來源: 題型:解答題
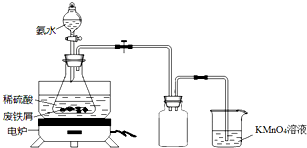 某實驗小組用廢鐵屑(含少量S等元素)為原料制備三草酸合鐵(Ⅲ)酸鉀晶體[K3Fe(C2O4)3•3H2O]并測定其組成.
某實驗小組用廢鐵屑(含少量S等元素)為原料制備三草酸合鐵(Ⅲ)酸鉀晶體[K3Fe(C2O4)3•3H2O]并測定其組成.
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com