
科目: 來(lái)源: 題型:解答題
| 起始物質(zhì)的量(mol) | 3 | 2 | 0 |
| 2s末物質(zhì)的量濃度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目: 來(lái)源: 題型:計(jì)算題
查看答案和解析>>
科目: 來(lái)源: 題型:實(shí)驗(yàn)題
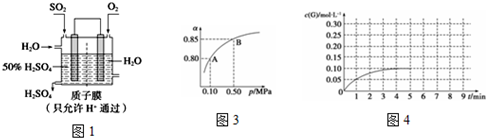
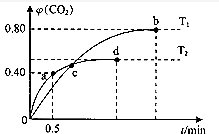
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
| 實(shí)驗(yàn)組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達(dá)到平衡所需時(shí)間/min | |
| CO | H2O | H2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 3 |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
| 溫度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
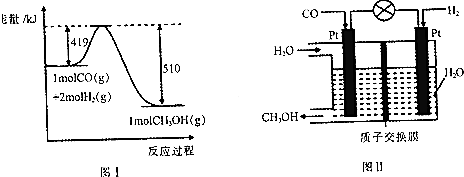
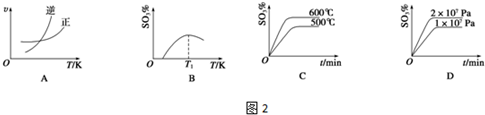
查看答案和解析>>
科目: 來(lái)源: 題型:解答題

查看答案和解析>>
科目: 來(lái)源: 題型:解答題
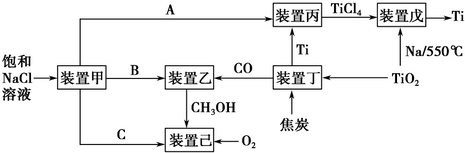
| 溫度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com