【題目】我國是個鋼鐵大國,鋼鐵產(chǎn)量為世界第一,高爐煉鐵是最為普遍的煉鐵方法。
I.已知反應(yīng) Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)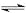
 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1��,該反應(yīng)在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1��,該反應(yīng)在
1000℃的平衡常數(shù)等于4��。在一個容積為10L的密閉容器中,1000℃時加入Fe��、Fe2O3����、CO��、CO2各1. 0mol,反應(yīng)經(jīng)過l0min后達(dá)到平衡����。
(1)CO的平衡轉(zhuǎn)化率=____________
(2)欲提高CO的平衡轉(zhuǎn)化率,促進Fe2O3的轉(zhuǎn)化,可采取的措施是________
a.提高反應(yīng)溫度
b.增大反應(yīng)體系的壓強
c.選取合適的催化劑
d.及時吸收或移出部分CO2
e.粉碎礦石,使其與平衡混合氣體充分接觸
Ⅱ.高爐煉鐵產(chǎn)生的廢氣中的CO可進行回收,使其在一定條件下和H2反應(yīng)制備甲醇:
CO(g)+ 2H2(g)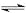 CH3OH(g)�����。請根據(jù)圖示回答下列問題:
CH3OH(g)�����。請根據(jù)圖示回答下列問題:
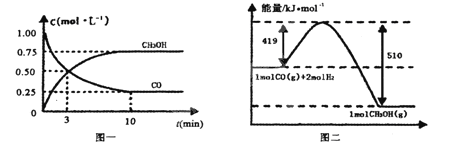
(1)從反應(yīng)開始到平衡,用H2濃度變化表示平均反應(yīng)速率v(H2)=________
(2)若在溫度和容器相同的三個密閉容器中,按不同方式投入反應(yīng)物,測得反應(yīng)達(dá)到平衡吋的有關(guān)數(shù)據(jù)如下表:
容器
| 反應(yīng)物投入的量
| 反應(yīng)物的
轉(zhuǎn)化率
| CH3OH的濃度
| 能量變化
(Q1���、Q2����、Q3均大于0)
|
甲
| 1mol CO和2mol H2
| α1
| c1
| 放出Q1kJ熱量
|
乙
| 1mol CH3OH
| α2
| c2
| 吸收Q2kJ熱量
|
丙
| 2mol CO和4mol H2
| α3
| c3
| 放出Q3kJ熱量
|
則下列關(guān)系正確的是________
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.該反應(yīng)若生成1mol CH3OH����,則放出(Q1+Q2)kJ熱量
Ⅲ.以甲烷為燃料的新型電池,其成本大大低于以氫為燃料的傳統(tǒng)燃料電池����,目前得到廣泛的研究,如圖是目前研究較多的一類固體氧化物燃料電池工作原理示意圖����;卮鹣铝袉栴}:
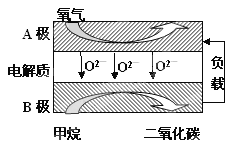
(1)B極上的電極反應(yīng)式為
(2)若用該燃料電池做電源����,用石墨做電極電解100mL 1mol/L的硫酸銅溶液�����,當(dāng)兩極收集到的氣體體積相等時�����,理論上消耗的甲烷的體積為 (標(biāo)況下)���。